
НАУКА
Физика
Атомы
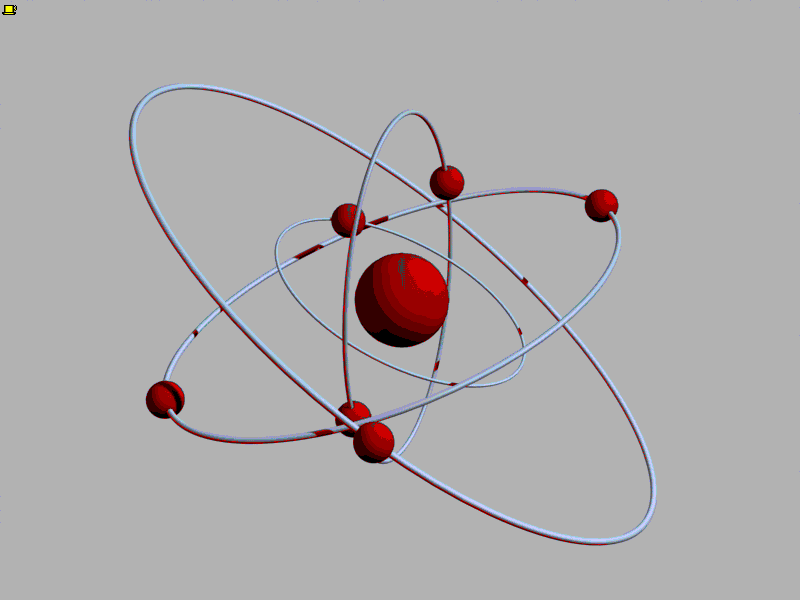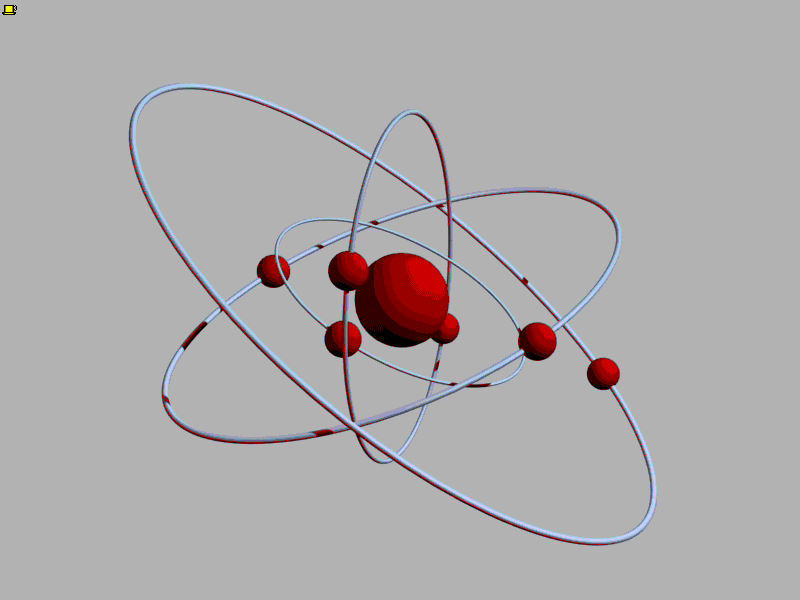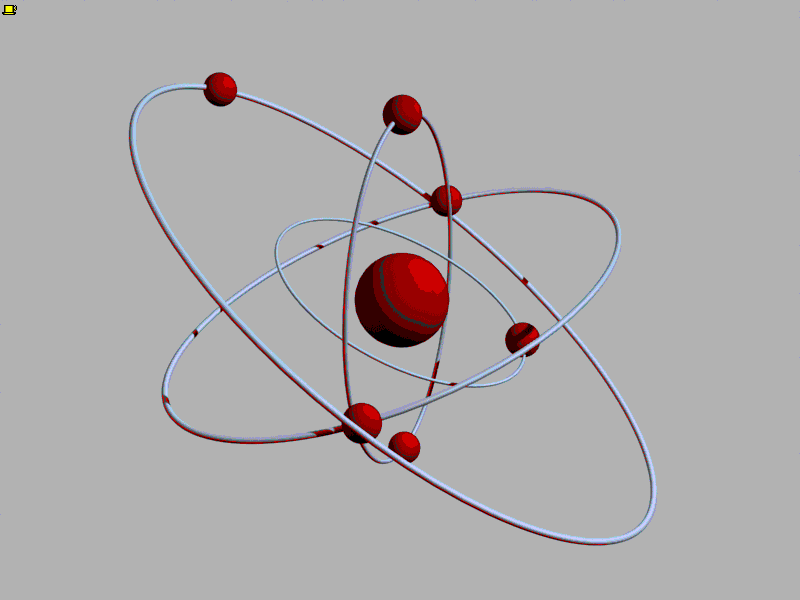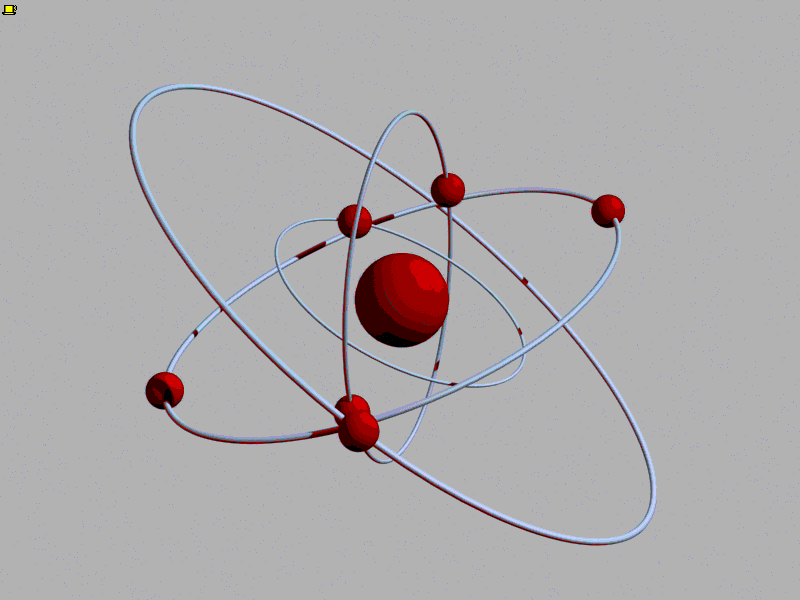
Впервые идея об атомах возникла в Древней Греции. Уже тогда люди стали задумываться, из чего состоит мир. Греки умели получать сплавы, например, соединяя медь и олово для получения бронзы. Тогда-то и появился вопрос: а что будет, если делить бронзу на части? Наверное, в конце концов останется самая маленькая частичка бронзы, которая после деления распадается на медь и олово. Отсюда шаг до следующей идеи - а вдруг на более простые части можно разделить не только частицу бронзы? Тогда самых простых веществ, которые уже больше нельзя разделить на составные части, может быть очень мало. Но из их различых сочетаний складывается целый мир!
Древнегреческая теория атома чаще всего приписывается Демокриту (460-370 до н.э.). Хотя идеи об атомах были очень просты по сравнению с нынешней концепцией, он ввёл в науку важную идею, состоящую в том, что все вещества состоят из неделимых частиц.
Древнегреческие философы предполагали, что атомы отличаются формой в зависимости от вещества, которое из них состоит. Например, атомы железа представлялись виде крючков, которые цеплялись друг за друга, что объясняло почему железо твёрдое, а атомы воды были гладкими и скользкими, поэтому вода жидкая. И хоть теперь мы знаем, что это не так, их идеи позволили разобраться в структуре вещества и создать современные модели.
Во времена средневековья греческое наследие, в том числе идея об атомах, было забыто, и вновь к атомам вернулись только в XIX веке. В 1803 году английский химик Джон Дальтон (в его же честь названо заболевание - дальтонизм) начал развивать научное определение атома. Он основывался на идеях древних греков в описании атомов как маленьких, твердых, неделимых сфер. Как и у греческих философов, у Дальтона атомы одного элемента абсолютно одинаковые. Это верно, но исключением являются изотопы различных элементов, которые отличаются по числу нейтронов. Однако нейтрон был обнаружен только в 1932 году, поэтому мы можем простить Дальтону эту ошибку. Дальтон также создал теорию о том, как атомы объединяются, образуя соединения, а также представил первый набор знаков для известных веществ.
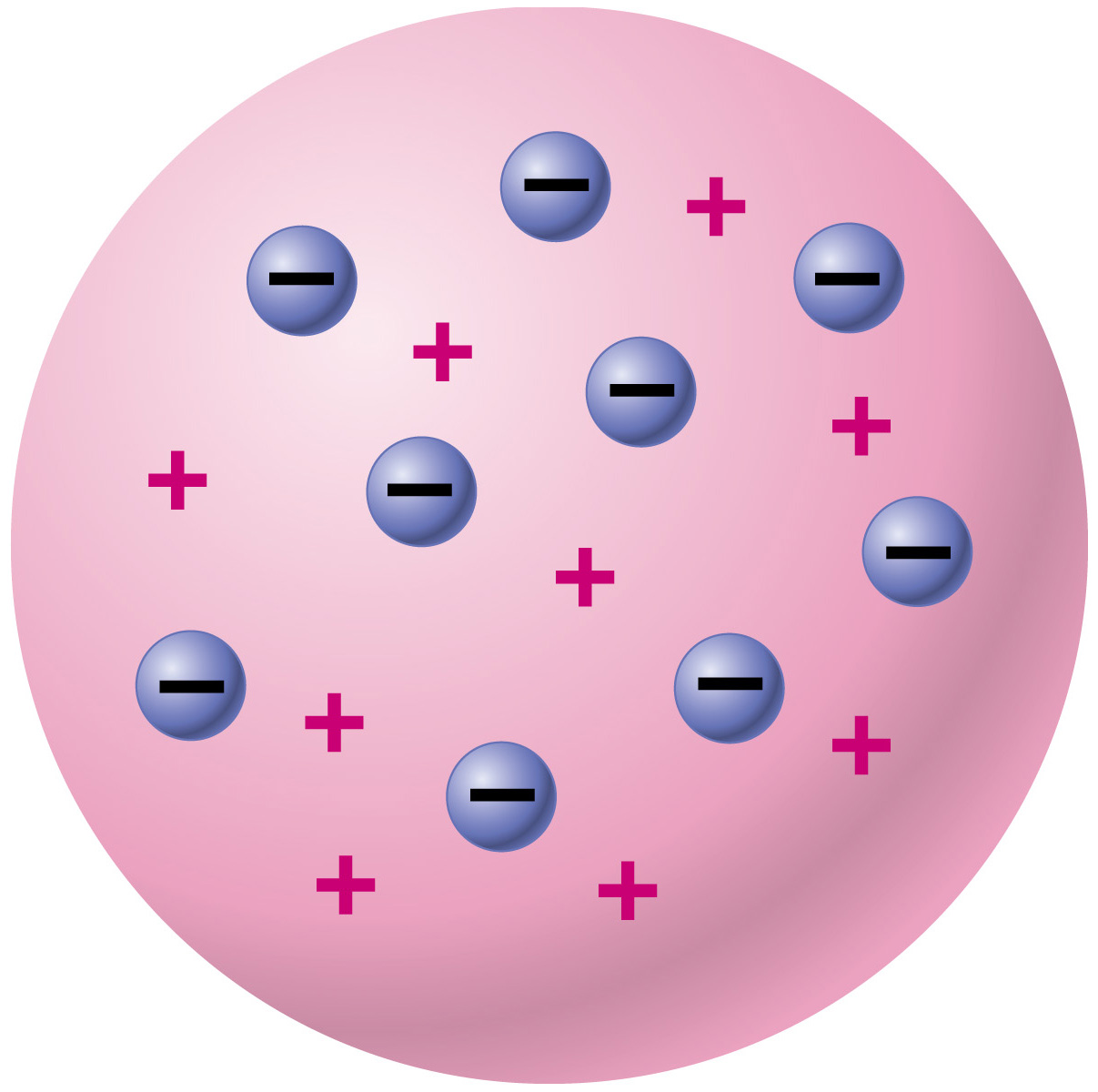
Следующий прорыв произошел в конце XIX века, когда английский физик Джозеф Джон Томсон обнаружил, что атом не неделим. Он, проводя эксперименты с использованием потоков электронов(катодных лучей), созданных в разрядной трубке, обнаружил, что лучи притягиваются положительно заряженными металлическими пластинами, но отталкивается отрицательно заряженными. Из этого он сделал вывод, что лучи тоже должны быть заряжены, причем отрицательно. Изучая частицы в лучах, он смог сделать вывод о том, что они были в две тысячи раз легче атома водорода, а также он показал, что эти частицы присутствовали во многих типах атомов. Таким образом он открыл электрон (хотя назвал его «корпускул») и показал, что атом делим. За это открытие он получил Нобелевскую премию в 1906 году. В 1904 году он выдвинул модель атома на основе своих выводов, названную «пудинговой моделью атома».
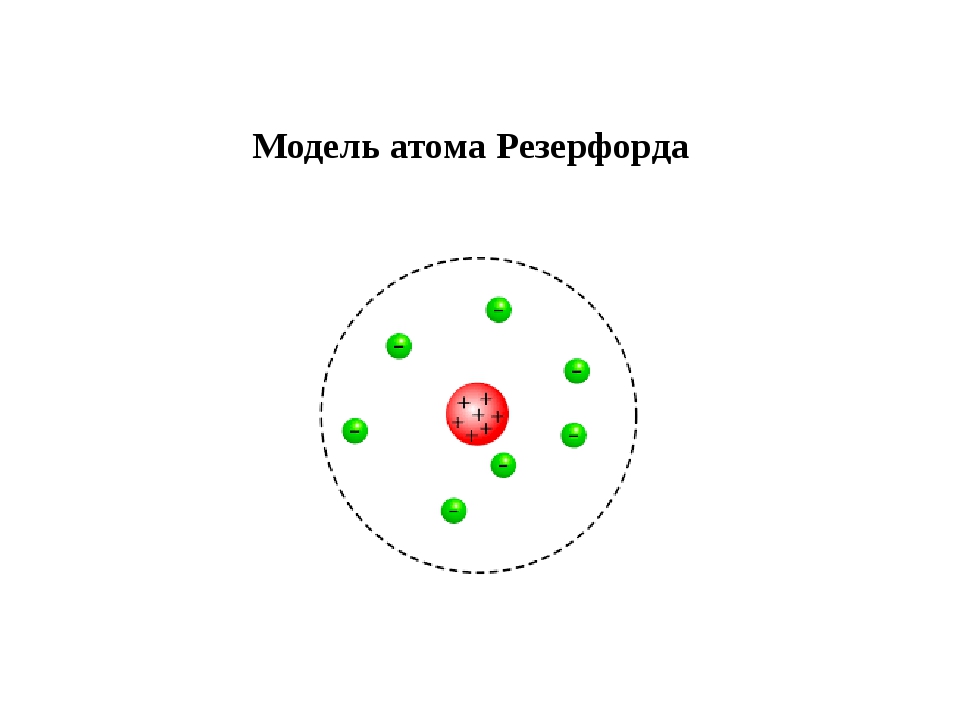
Эрнест Резерфорд был физиком из Новой Зеландии, он обучался в Кембриджском университете у Томсона. Работая в Университете Манчестера, он создал новую модель атома. Его работа была опубликована уже после того, как он получил Нобелевскую премию в 1908 году за исследования в химии радиоактивных веществ. Резерфорд разработал эксперимент, который помог исследовать атомную структуру. Для этого он стрелял альфа-частицами в тонкий лист золотой фольги. Альфа-частицы из-за своего маленького размера проходили фольгу насквозь. В соответствии с моделью Томсона, частицы должны были пройти через фольгу без отклонения. Резерфорд хотел подтвердить модель Томсона, но все оказалось наоборот. В ходе эксперимента большинство из альфа-частиц проходили через фольгу без отклонения, но некоторые частицы отклонялись на очень большой угол. Это было очень неожиданно. Единственным возможным объяснением было то, что положительный заряд не распределён по всему атому, а расположен в центре атома - ядре. Согласно этой модели, большой частью остальной части атома являлось просто пустое пространство.
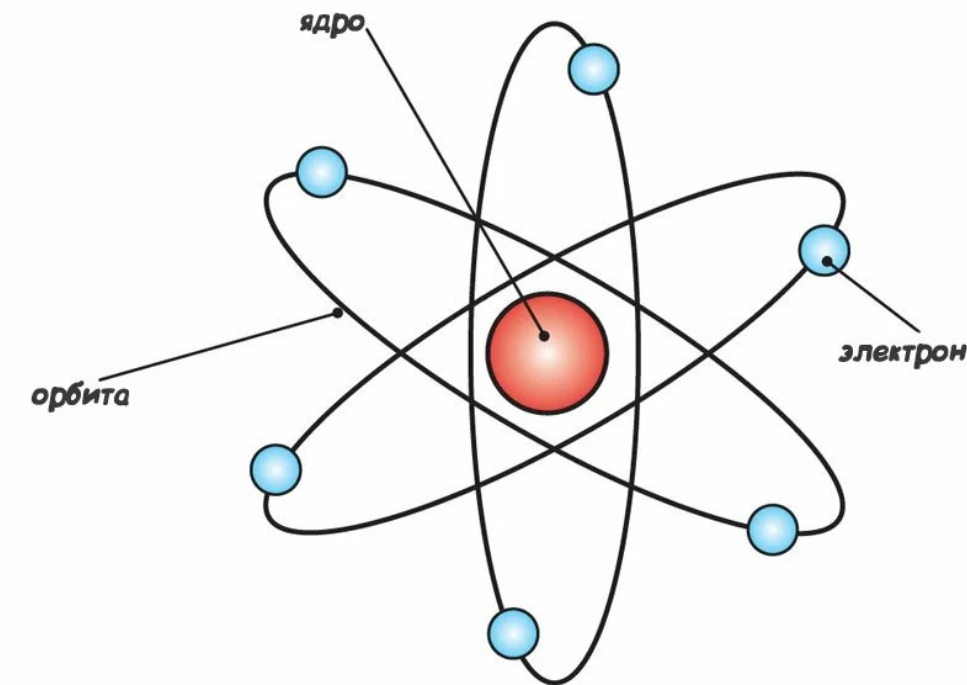
Новую модель предложил датский физик Нильс Бор. Так как классическая физика не могла правильно объяснить, что происходит в атоме, Бор обратился к квантовой механике.
"Мы не можем знать точное местоположение и скорость электрона одновременно."
Тем не менее, модель Бора наиболее широко распространена и известна из-за удобства объяснения химических связей между элементами в школе.
Физика
Атомы

Древнегреческая теория атома чаще всего приписывается Демокриту (460-370 до н.э.). Хотя идеи об атомах были очень просты по сравнению с нынешней концепцией, он ввёл в науку важную идею, состоящую в том, что все вещества состоят из неделимых частиц. Древнегреческие философы предполагали, что атомы отличаются формой в зависимости от вещества, которое из них состоит. Например, атомы железа представлялись виде крючков, которые цеплялись друг за друга, что объясняло почему железо твёрдое, а атомы воды были гладкими и скользкими, поэтому вода жидкая. И хоть теперь мы знаем, что это не так, их идеи позволили разобраться в структуре вещества и создать современные модели.
Во времена средневековья греческое наследие, в том числе идея об атомах, было забыто, и вновь к атомам вернулись только в XIX веке. В 1803 году английский химик Джон Дальтон (в его же честь названо заболевание - дальтонизм) начал развивать научное определение атома. Он основывался на идеях древних греков в описании атомов как маленьких, твердых, неделимых сфер. Как и у греческих философов, у Дальтона атомы одного элемента абсолютно одинаковые. Это верно, но исключением являются изотопы различных элементов, которые отличаются по числу нейтронов. Однако нейтрон был обнаружен только в 1932 году, поэтому мы можем простить Дальтону эту ошибку. Дальтон также создал теорию о том, как атомы объединяются, образуя соединения, а также представил первый набор знаков для известных веществ.
Следующий прорыв произошел в конце XIX века, когда английский физик Джозеф Джон Томсон обнаружил, что атом не неделим. Он, проводя эксперименты с использованием потоков электронов(катодных лучей), созданных в разрядной трубке, обнаружил, что лучи притягиваются положительно заряженными металлическими пластинами, но отталкивается отрицательно заряженными. Из этого он сделал вывод, что лучи тоже должны быть заряжены, причем отрицательно. Изучая частицы в лучах, он смог сделать вывод о том, что они были в две тысячи раз легче атома водорода, а также он показал, что эти частицы присутствовали во многих типах атомов. Таким образом он открыл электрон (хотя назвал его «корпускул») и показал, что атом делим. За это открытие он получил Нобелевскую премию в 1906 году. В 1904 году он выдвинул модель атома на основе своих выводов, названную «пудинговой моделью атома».

Эрнест Резерфорд был физиком из Новой Зеландии, он обучался в Кембриджском университете у Томсона. Работая в Университете Манчестера, он создал новую модель атома. Его работа была опубликована уже после того, как он получил Нобелевскую премию в 1908 году за исследования в химии радиоактивных веществ. Резерфорд разработал эксперимент, который помог исследовать атомную структуру. Для этого он стрелял альфа-частицами в тонкий лист золотой фольги. Альфа-частицы из-за своего маленького размера проходили фольгу насквозь. В соответствии с моделью Томсона, частицы должны были пройти через фольгу без отклонения. Резерфорд хотел подтвердить модель Томсона, но все оказалось наоборот. В ходе эксперимента большинство из альфа-частиц проходили через фольгу без отклонения, но некоторые частицы отклонялись на очень большой угол. Это было очень неожиданно. Единственным возможным объяснением было то, что положительный заряд не распределён по всему атому, а расположен в центре атома - ядре. Согласно этой модели, большой частью остальной части атома являлось просто пустое пространство.

Новую модель предложил датский физик Нильс Бор. Так как классическая физика не могла правильно объяснить, что происходит в атоме, Бор обратился к квантовой механике.
